1. Kol förekommer naturligt som tre former i naturen
2. Vad är en organisk förening?
3. Vilken är den hårdaste formen av kol respektive den
"mjukaste". Vad skiljer dem åt?
4. Alkaner (metanserien) fram till oktan
5. Alkener fram till okten
6. Alkyner fram till oktyn
7. Alkoholer fram till oktanol
8. Organiska syror fram till oktansyra
9. Veta hur en kovalent bindning fungerar.
10. Frågor
Kol förekommer naturligt som minst tre former i naturen
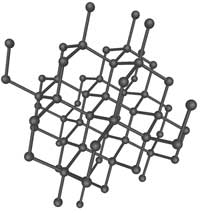
1. Diamant. (Info om bild). Endast kol bygger
upp denna kristall. Varje kolatom binder till fyra
andra kolatomer i ett helt regelbundet
tredimensionellt nätverk. Diamant är det hårdaste av
alla kända mineral.
Användningsområde: smycke, som nötningsmedel i
borrkärnor.
Bildas: Bildas under högt tryck och temperatur i
jordens mantel ganska långt ner i jorden.

2. Grafit. (Info om bild). Här binder varje
kolatom till tre andra kolatomer i ett sexkantigt
mönster, där varje hörn utgörs av en kolatom. Detta
mönster utbreder sig i ett plan och dessa plan bildar
skikt. Dessa skikt hålls samman av svaga bidningar.
Detta gör att grafit är ett av de mjukare mineral vi
har på jorden.
Användningsområde: i blyertspennor - svärtan som
fastnar på pappret är avskrapade skikt. Blyerts leder
ström ganska dåligt och används därför i elektriska
kretsar som motstånd. Grafit kan brinna och kan
användas som bränsle.
Bildning: Bildas genom att växtdelar och döda djur
förmultnar under frånvaro av syre. Detta sker ofta
samtidigt som materialet paketeras under
sedimentmassor av eroderat berg.
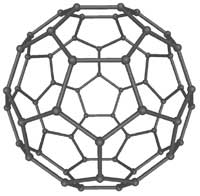
3. Fulleren. (Info om bild). Varje kolatom
binder till tre andra kolatomer i mönster om
sexkantiga och femkantiga ringar. I varje hörn sitter
en kolatom. Dessa sexkantiga och femkantiga strukturer
bygger upp former som ser ut som fotbollar och små
tuber.
Användningsområde: Vetenskapsmänniskor undersöker
möjligheterna att skapa en bildskärm som skall bestå
av nanotuber. Skärmen väntas bli tunnare än ett
papper.
Vad är en
organisk förening?
En organisk förening är en kemisk förening som
innehåller grundämnet kol. Ex metan, klorofyll eller
b-vitamin.
Vilken är den hårdaste
formen av kol respektive den
"mjukaste". Vad skiljer dem åt?
Den "hårdaste" formen av kol är diamant. Den blir
extra hållbar pga. att varje kolatom binder till just
fyra andra kolatomer i ett tredimentionellt
symmetriskt nätverk.
Den mjukaste formen av kol är grafit. Det är mjukt
eftersom kolatomerna ligger i skikt och lätt kan
skrapas av. Svaga bindningar håller samman skikten.
Alkaner (metanserien) fram till oktan
Alla streck mellan atomerna nedan är symboler för
kovalenta bindningar. En kovalent bindning består av
två elektroner. Nedan visas strukturformler för
alkaner.
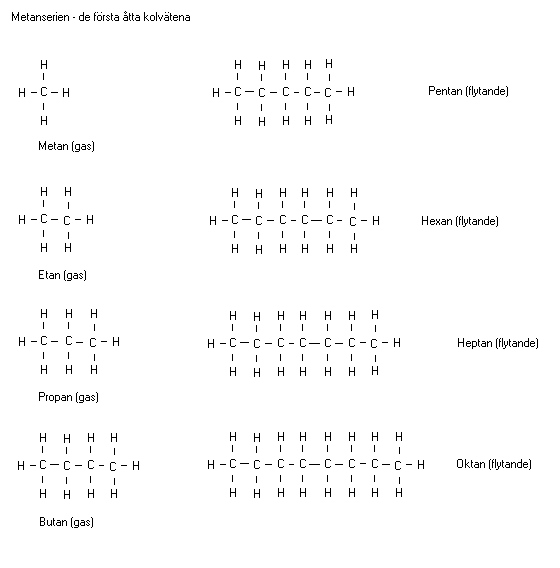
Givetvis fortsätter serien och ännu fler kolatomer kan
kopplas på rad. Alla ämnen som ingår i metanserien
kallas alkaner. Observera att alla alkaner har
ändelsen an. Ju fler kolatomer som igår på rad desto
tyngre blir alkanerna. Brytpunkten mellan gasformiga
och flytande alkaner i rumstemperatur (25oC) är mellan
butan och pentan. Alkaner med 17 kolatomer eller mer
är fast i rumstemperatur.
Alkener fram till okten
Alkener är en alkaner som har fått en dubbelbindning.
Alla alkeners namn slutar på en. Nedan visas tre
exempel:
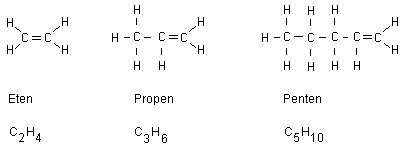
Givetvis kan dubbelbindningen istället vara placerad
mellan två andra kolatomer i kedjan. Observera att en
kolatom bara kan binda med fyra kovalenta bindningar
(elektronparbindningar). En dubbelbindning håller på
mer energi än en vanlig enkelbindning. Detta gör att
när ämnet med en dubbelbindning brinner så frigörs mer
energi jämfört med när ett kolväte med enkelbindningar
brinner. Ovanstående alkener brinner alltså med högre
temperaturer jämfört med alkaner.
Alkyner fram till oktyn
Alkyner är alkaner som har fått en trippelbindning.
Alla alkyners namn slutar på yn. Nedan visas tre
exempel:
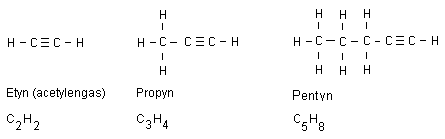
En trippelbindning håller på ännu mer energi jämfört
med en dubbelbindning. Etyngas som går under
populärnamnet acetylengas brinner med en temperatur på
lite mer än 3000 oC. Detta gör gasen lämplig att
använda vid svetsning då en hög temperatur behövs.
Acetylengas förvaras i gastub. Gasen släpps ut med ett
kontrollerat flöde och gasutflödet antänds. Lågan är
blå, intensiv och extremt varm.
Alkoholer fram till oktanol
En alkohol är en alkan som har fått en bunden väteatom
ersatt med en OH-grupp. Alla alkoholers namn slutar på
ol.
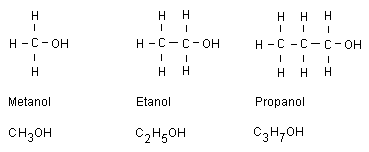
Metanol
Metanol är väldigt giftig. Redan vid ett litet intag
av vätskan blir man blind och vid en aning större
doser dör man. Om man har blivit metanolförgiftad
skall man inta etanol och även större doser av
bikarbonat. Avgiftning sker hos läkare. Metanol har
vid vissa tillfällen förväxlats med etanol, som i
vanligt tal benämns som sprit och finns i
alkoholhaltiga drycker ex. öl, vin och sprit.
Etanol
Finns som berusningsmedel i öl, vin och sprit. Etanol
är ett gift.
Organiska syror fram till oktansyra
En karboxylsyra är en alkan som har fått en bunden
väteatom ersatt med en COOH-grupp. Alla syror med
denna COOH-grupp kallas för karboxylsyror.
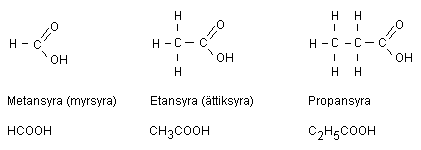
Metansyra (myrsyra)
Metansyra kan man märka av om man terroriserar myror i
en myrstack. Om man därefter närmar sin näsa till
myrstacken kan man känna av en stickande lukt. Har man
ett sår på handen och närmar denna till myrstacken kan
man även känna att det svider i handens sår. Ett
myrbett ger också ett bevis på vad myrsyra kan ställa
till med.
Myrsyra används som konserveringsmedel till ensilage.
Ensilage är gräs och hö som förvaras i stora silos på
bondgårdar. För att de nyttiga mjölksyrabakterierna
skall få övertag i dessa silos så tillsätts en viss
del myrsyra. Dessa silos kan sedan förvara gräset och
höet under vintern så att kor och hästar får bra mat
även då.
Etansyra (ättiksyra)
Etansyra kan användas för att lägga in gurka och som
ingrediens i fönsterputsmedel.
Veta hur en
kovalent bindning fungerar
Kovalent bindning kallas även för elektronparbindning.
En kovalent bindning är ett sätt för ex kolatom att
låna ut en elektron till en annan atom, samt ett sätt
för den andra atomen att dela med sig av sin elektron.
På detta sätt upplever båda atomerna att de har en
extra elektron. Kovalenta bindningar används så att de
ingående atomerna får sitt yttersta elektronskal att
likna ädelgasernas yttersta skal, dvs. atomerna får
ädelgaskonfiguration. Väte har då två elektroner i
sitt yttersta skal som heliumatomen (He). Kolatomen
har då åtta elektroner i sitt yttersta skal som övriga
ädelgaser. Ädelgaserna finns längst till höger i
periodiska systemet.
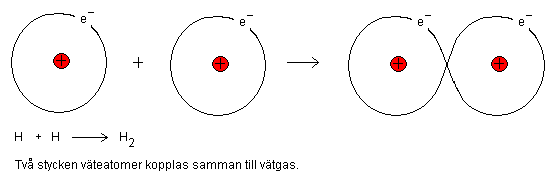
Båda väteatomerna upplever då att de har två
elektroner. Följer du följer väte i det periodiska
systemet vidare till höger, så ser du att den sista
atomen i perioden är helium. Helium har också två
elektroner i sitt yttersta skal.
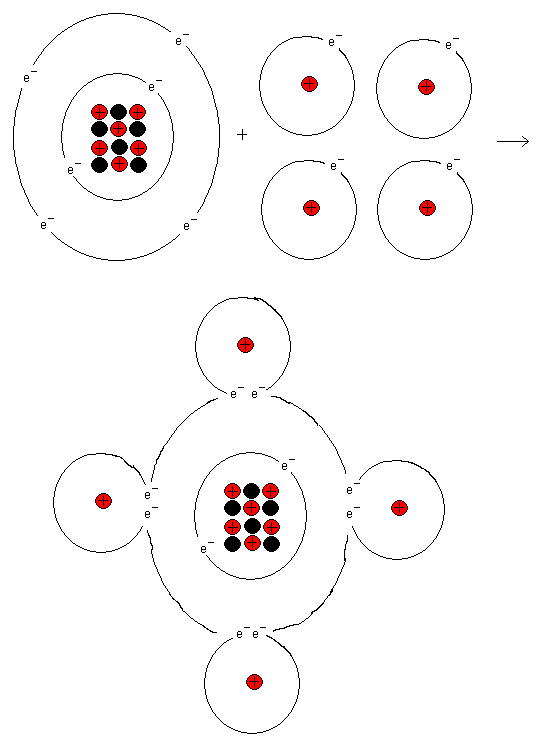
En kolatoms yttersta skal vill ha åtta elektroner.
Från början har kolatomen fyra elektroner men om den
binder till fyra väteatomer så får kolatomen åtta
stycken elektroner i sitt yttersta skal. Kolatomen får
då ädelgasstruktur och efterliknar Neon. Följ i det
periodiska systemet från kol ut till höger. Där hittar
du Neon (Ne).
På liknande sätt får också väteatomerna
ädelgasstruktur. De upplever att de har två stycken
elektroner var.
Atomer blir mer stabila om de får ett yttre skal som
ser ut som ett yttersta ädelgasskal. Vätgas är såpass
stabil att den återfinns i atmosfären, fast mycket av
den vätgas som har funnits i vår atmosfär har
försvunnit ut i rymden, eftersom gasen är så lätt.
Även metangas är stabil och återfinns i atmosfären.
Metangas är 25 ggr mer aggressiv som växthusgas
jämfört med koldioxid, som mer förknippas som
växthusgas. Växthusgaser bidrar till växthuseffekten.
Frågor
1. Rita strukturformel för metan, etan och hexan?
2. Var går gränsen mellan flytande och gasformiga
kolväten?
3. Var går gränsen mellan flytande och fasta kolväten?
4. Skriv kemisk beteckning för etan och oktan?
5. Vad är gemensamt för alla alkener?
6. Nämn en egenskap som är samma för alla alkener?
7. Var är gemensamt för alla alkyner?
8. Vilken egenskap får ett kolväte som har en dubbel
eller trippelbindning?
9. Skriv kemisk beteckning för etyn och propen?
10. Vad krävs för att en molekyl skall få kallas för
en alkohol?
11. En av alkoholerna har konstigt nog förväxlats med
etanol - vilken?
12. Vad skall man göra om en person har blivit
förgiftad med metanol?
13. Skriv kemisk beteckning för propanol och hexanol?
14. Vad är gemensamt för att karboxylsyrar?
15. Rita strukturformel för oktansyra och propansyra?
16. Vad är en kovalent bindning?
17. Visa hur en kovalent bindning fungerar hos en
etenmolekyl?
18. Vad händer om man blandar en organisk syra med en
alkohol?
19. Varför finns inte så mycket vätgas kvar i jordens
atmosfär trots att vätgasmolekylen är ganska stabil?
De naturvetenskapliga grundkurserna för högstadiet är skrivna av Lars Helge Swahn. Kurserna är utvecklade under 9 års tid och har använts för höstadiets åk 8 och 9. De är ämnade att ge snabbt eleven en övergripande bild om respektive arbetsområde. För LPO 94 täcker kurserna nivån G och ger även viss information för betyget VG.
Copywrite NGU, Northern Pontifical Academy 2025 (A.I.C.)