1. Vad är en syra? - Skillnad mellan starka och svaga
syror?
2. Ge exempel på syror i din närhet och vad de används
till
3. Nämn två svaga syror, kemisk beteckning, egenskaper?
4. Nämn tre starka syror, kemisk beteckning, egenskaper?
5. SIV-regeln
6. Vad är en bas?
7. Nämn en svag bas, kemisk beteckning, egenskaper?
8. Nämn två starka baser, kemisk beteckning, egenskaper?
9. Vad är en neutralisation, ge också exempel?
10. Vad är BTB (bromtymolblått)? Vilka färgen har den i
sur, neutral och basisk lösning?
11. Hur fungerar pH-skalan?
12. Vad innebär det om en lösning är: utspädd,
koncentrerad eller mättad?
13. Frågor
Vad är en syra? - skillnad mellan starka och svaga syror?
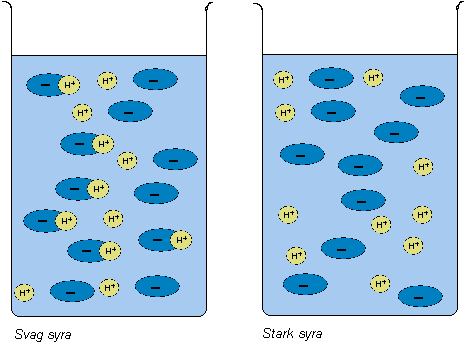
En syra är ämne som lämnar eller kan lämna ifrån sig
en vätejon (H+). Detta gör att det finns fria
vätejoner i lösningen. Lösningen blir därmed sur. En
stark syra lämnar alltid ifrån sig en vätejon och en
svag syra lämnar ibland ifrån sig en vätejon. Detta
gör att även en svag syra har en sur lösning, eftersom
det finns fria vätejoner i lösningen.

Syror kan ge otäcka frätskador och kan även lösa upp
metaller. Därför har flaskor med syra ofta
varningssymbolen "varning frätande".
Ge exempel på
syror i din närhet och vad de används
till
Svaga syror:
Ättiksyra: används inläggning av ex gurka, eller som
del i fönsterputsmedel.
Citronsyra: används vid matlagning för surgörning,
eller som del i konserveringsmedel
Starka syror:
Svavelsyra: Används som vätska (elektrolyt) i
bilbatterier.
Nämn två svaga syror,
kemisk beteckning, egenskaper?
Metansyra (myrsyra): HCOOH
Användning: ensilering av gröda för konservering till
vintern. Gröda som mat till djur kan på detta sätt
sparas till vinterhalvåret. Mjölksyrabakterier surgör
då grödan så att grödan konserveras.
Myrsyra ger sig till känna när man rör om i en
myrstack. Myrorna avger denna syra som ett led i sitt
försvarssystem. Har man ett sår på handen och rör om i
stacken så svider såret ordentligt. (OBS! var
försiktiga och hänsynsfulla mot myror - de samarbetar
bättre än människor - se och lär).
Etansyra (ättiksyra): CH3COOH
Ren ättiksyra stelnar redan vid en temperatur på 17
oC. Syran kan framställas i en rad olika reaktioner,
bl.a. genom torrdestillation av trä eller genom att
etanol omvandlas under inverkan av vissa bakterier.
Nämn tre
starka syror, kemisk beteckning, egenskaper?
Saltsyra: (HCl)
HCl är egentligen en gas. Denna löses i vatten och
saltsyra bildas. Saltsyra ryker ofta vilket är ett
resultat av att syran lämnar vätskan som gas. Gasen
kan återigen bilda små droppar av saltsyra. Saltsyra
har en stickande karakteristisk lukt. Exempel på hur
saltsyra reagerar i vatten:
HCl
 H+ + Cl-
H+ + Cl-
I vätskan finns fria vätejoner och fria kloridjoner.
Svavelsyra: (H2SO4)
Svavelsyra är en luktlös syra med en ganska hög
densitet. Den kan verka en aningens seg. En
anmärkningsvärd egenskap är att syran absorberar
vatten. Därför har den tidigare använts till att fånga
upp fukt i mellanfönster. Behållaren med syra får med
jämna mellanrum tömmas, eftersom vätskemängden hela
tiden ökar, och i så fall rinner över kanten på
behållaren.
Salpetersyra: (HNO3)
Salpetersyra förvaras mörkt eftersom den annars
sönderdelas av solljus. Syran har en förmåga att
gulfärga proteiner. Detta kan visas om en droppe syra
placeras på ex en nagel. Efter en stund färgas nageln
gul. Då syran reagerar med oädla metaller avges gaser
som kallas nitrösa gaser. Dessa är rödbruna och mycket
giftiga.
SIV-regeln:
När man blandar syra och vatten skall man alltid hälla
syran i vattnet. Anledningen är att värme utvecklas då
man blandar dessa två ämnen. Om man häller vatten i
syra kommer vattendroppen att omedelbart bli mycket
varm och denna kan övergå till gasform. Skulle detta
ske finns risken att droppen skvätter upp och tar med
sig syra. Stänk kan därför överraska personen som
blandar. Häller man istället syran i vattnet undviker
man denna sk. stötkokning.
Vad är en
bas?
En bas är ett ämne som kan ta upp en vätejon. Ett
exempel på en bas är ammoniak (NH3). När ammoniak
hälls i vatten, kommer ammoniaken att reagera med
vattnet och ta en vätejon från en vattenmolekyl. Kvar
av den trasiga vattenmolekylen, finns en syreatom och
en väteatom som sitter ihop som en hydroxidjon (OH-).
I en lösning av en bas finns alltså hydroxidjoner.

Baser löser upp fett och har därför varningssymbol
"varning frätande".
Nämn en
svag bas, kemisk beteckning, egenskaper?
Ammoniak är en svag bas eftersom bara en del av
ammoniakmolekylerna reagerar med vattenmolekyler och
tar upp deras vätejoner och lämnar kvar hydroxidjoner.
Nedan visas ett exempel på hur en ammoniakmolekyl
reagerar med en vattenmolekyl:
NH3 + H2O
 NH4+ + OH-
NH4+ + OH-
Den dubbelriktade pilen betyder att inte alla
ammoniakmolekyler reagerar med vattenmolekyler.
Reaktionen gör att det finns fria hydroxidjoner i
lösningen, men att det också finns ammoniakmolekyler
som inte har reagerat med vattenmolekyler. Faktum är
att reaktionen kan gå åt båda håll.
Nämn två starka
baser, kemisk beteckning, egenskaper?
Starka baser fungerar på ett lite annorlunda sätt.
Starka baser är för det mesta salter.

Bilden ovan visar kristaller av natriumhydroxid.
Saltet ser ut som små flingor.
Om man löser ett salt i vatten så frigörs saltets
positiva och negativa joner. Basen natriumhydroxid
(NaOH) kommer att frigöra natriumjoner (Na+) och
hydroxidjoner (OH-). Detta sker enligt
reaktionsformeln:
NaOH
 Na+ + OH-
Na+ + OH-
Hydroxidjonen är den jon som gör lösningen basisk.
Alla hydroxidjonerna lösgör sig från natriumjonerna.
Man säger då att basen är stark.
Ett annat exempel på en stark bas är kaliumhydroxid.
Kaliumhydroxid löses i vatten enligt:
KOH
 K+ + OH-
K+ + OH-
Vad är en
neutralisation, ge också exempel?
En neutralisation sker om en syra reagerar med en bas.
Exempel:
HCl + NaOH
 Na+ + Cl- + H2O
Na+ + Cl- + H2O
Natriumjoner och kloridjoner är fria i lösningen. Kvar
återstår vanligt saltvatten. Vätejoner och
hydroxidjoner reagerar alltså enl.
H+ + OH-
 H2O
H2O
En neutralisation har skett. Syran har neutraliserat
basen eller omvänt, basen har neutraliserat syran.
Vad är BTB (bromtymolblått)? Vilka färgen har den i
sur, neutral och basisk lösning?
En syra-basindikator indikerar om en lösning är sur
eller basisk. BTB (Bromthymolblått) är en vanlig
indikator.
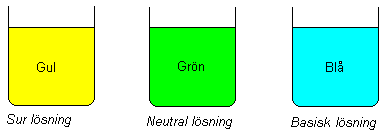
Hur fungerar
pH-skalan?
pH < 7 : sur lösning. Här finns vätejoner (H+)
pH = 7 : neutral lösning
pH > 7 : basisk lösning. Här finns hydroxidjoner (OH-)
![]()
Vad innebär det om en lösning är: utspädd,
koncentrerad eller mättad?

I en utspädd lösning finns bara lite salt löst. I en
koncentrerad lösning finns så mycket salt löst, att en
gnutta extra salt inte skulle lösa sig, utan istället
bilda en olöslig hög på botten. En sådan lösning
kommer då att kallas mättad.
Frågor
1.
Vad är en syra?
2.
Vilken typ av jon avger en syra?
3.
Nämn en svag syra?
4.
Nämn en stark syra?
5.
Vilken är skillnaden mellan en svag och en stark syra?
6.
Vilken är den kemiska beteckningen för metansyra?
7.
Vilken är metansyras populärnamn?
8.
Till vad ändvänds myrsyra?
9.
Vilken är den kemiska beteckningen för etansyra?
10.
Vilken är etansyras populärnamn?
11.
Till vad används etansyra?
12.
Nämn kemisk beteckning för svavelsyra?
13.
Nämn kemisk beteckning för saltsyra?
14.
Nämn kemisk beteckning för salpetersyra?
15.
Visa hur saltsyra löser upp sig i vatten - med kemiska
beteckningar?
16.
Vad står bokstäverna i SIV-regeln för?
17.
Vad är SIV-regeln för något - vad menas med den?
18.
Definiera en bas - vad är alltså en bas?
19.
Vilken jon finns alltid i en vattenlösning av en bas?
20.
Nämn en svag bas med namn och kemisk beteckning?
21.
Visa med kemisk reaktionsformel hur denna svaga bas
löser sig i vattenlösning?
22.
Namn en stark bas med namn och kemisk beteckning?
23.
Visa hur denna starka bas kan lösa upp sig i vatten?
24.
Vilken är skillnaden mellan en svag och en stark bas?
25.
Vad är en neutralisation?
26.
Visa med kemiska beteckningar hur saltsyra
neutraliseras med natriumhydroxid?
27.
Vad är bromthymolblått (BTB)?
28.
Vilken färg får BTB i sur, neutral och basisk lösning?
29.
Berätta om pH-skalan?
30.
Vad innebär alltså ett lågt pH-värde?
31.
Vad innebär ett högt pH-värde?
32.
Vad är en utspädd lösning?
33.
Vad är en koncentrerad lösning?
34.
Vad är en mättad lösning?
De naturvetenskapliga grundkurserna för högstadiet är skrivna av Lars Helge Swahn. Kurserna är utvecklade under 9 års tid och har använts för höstadiets åk 8 och 9. De är ämnade att ge snabbt eleven en övergripande bild om respektive arbetsområde. För LPO 94 täcker kurserna nivån G och ger även viss information för betyget VG.
Copywrite NGU, Northern Pontifical Academy 2025 (A.I.C.)